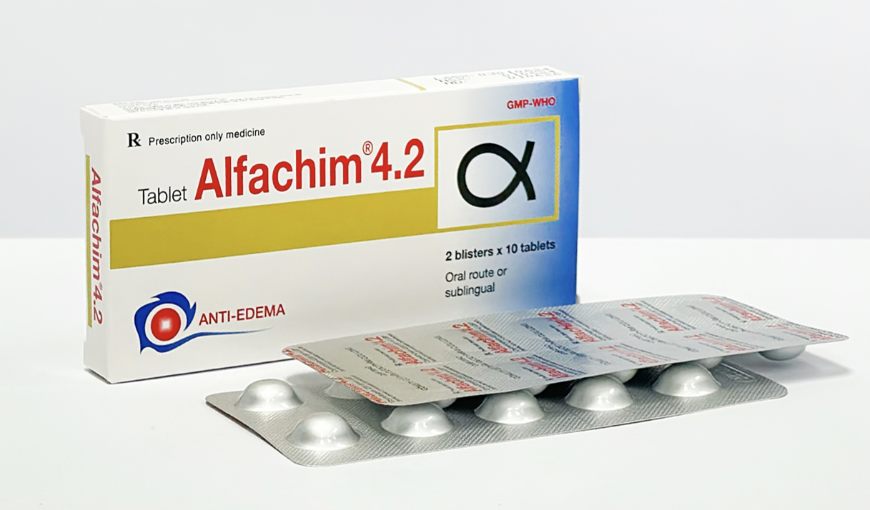
Bộ Y tế mới đây ra quyết định thu hồi trên toàn quốc lô thuốc viên nén Alfachim 4.2 do Công ty cổ phần dược phẩm Cửu Long sản xuất. Đây là loại thuốc chống phù nề và kháng viêm; dùng trong điều trị phù nề sau chấn thương, bỏng, sau phẫu thuật.
Thuốc này có số giấy đăng ký lưu hành VD-34573-20, Số lô bị thu hồi là 03010624; ngày sản xuất 1/6/2024; hạn dùng 1/6/2026.
Trước đó, ngày 15/5, Viện Kiểm nghiệm thuốc Trung ương gửi báo cáo về Cục Quản lý Dược về việc mẫu thuốc trên đây lấy tại Công ty cổ phần Dược - Vật tư y tế Ngọc Khánh (quầy 312A, tầng 3, Hapu Medicenter - Số 1, Nguyễn Huy Tưởng, Thanh Xuân, Hà Nội) không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng (vi phạm mức độ 2).
5 ngày sau, Cục Quản lý Dược yêu cầu thu hồi lô thuốc này trên địa bàn Hà Nội.
Một tháng sau khi yêu cầu thu hồi lô thuốc tại Hà Nội, Cục Quản lý Dược mở rộng phạm vi, thu hồi trên toàn quốc.
Lý giải nguyên nhân vì sao hơn 1 tháng sau khi phát hiện lô thuốc vi phạm mức độ 2 Cục mới đưa ra quyết định này, đại diện Cục Quản lý Dược cho biết, điều này thực hiện theo Thông tư 11/2018 (quy định tại Điều 14).
Theo đó, mẫu vi phạm trong lô thuốc được lấy tại cơ sở bán buôn (thuộc Khoản 2 Điều 14), Cục Quản lý Dược ban hành quyết định thu hồi thuốc trên địa bàn tỉnh, thành phố trực thuộc Trung ương nơi lấy mẫu (cụ thể trong lô này là ở Hà Nội) và các cơ sở kinh doanh, sử dụng đã được cơ sở bán buôn nơi lấy mẫu thuốc cung cấp.
Pháp luật cũng quy định Cục phải yêu cầu cơ sở đăng ký, cơ sở sản xuất hoặc cơ sở nhập khẩu có trách nhiệm báo cáo về việc phân phối thuốc gửi Bộ Y tế; Đề nghị cơ quan kiểm tra chất lượng lấy mẫu bổ sung ít nhất 2 mẫu thuốc tại cơ sở bán buôn khác...; Gửi mẫu đã lấy tới cơ sở kiểm nghiệm tuyến Trung ương để kiểm tra chất lượng đối với chỉ tiêu không đạt.
Trong trường hợp này, song song với việc yêu cầu thu hồi lô thuốc tại Hà Nội, Cục Quản lý Dược yêu cầu Công ty cổ phần dược phẩm Cửu Long phối hợp lấy 2 mẫu bổ sung và gửi mẫu đã lấy tới Viện Kiểm nghiệm thuốc Trung ương hoặc Viện Kiểm nghiệm thuốc TPHCM (là cơ quan thuộc Bộ Y tế) để kiểm tra chất lượng đối với chỉ tiêu định lượng (chỉ tiêu vi phạm trong lô thuốc lấy mẫu trước đó).
Việc thu hồi lô thuốc trên toàn quốc (mà mẫu ban đầu được lấy tại cơ sở bán buôn) được thực hiện khi có kết quả khẳng định ít nhất 2 mẫu thuốc trong lô vi phạm. Trong trường hợp này, dù doanh nghiệp chưa làm xong việc báo cáo kết quả kiểm nghiệm thêm mẫu, nhưng lại có đơn xin thu hồi tự nguyện do lô thuốc lưu tại kho để kiểm tra chất lượng không đạt yêu cầu.
"Vì thế, Cục ra quyết định thu hồi toàn bộ lô thuốc mà không cần chờ kết quả kiểm tra chất lượng mẫu lô thuốc tại các cơ sở khác", đại diện Cục Quản lý Dược cho hay.
- Mức 1 là nghiêm trọng nhất (là thuốc vi phạm có nguy cơ gây tổn hại nghiêm trọng đối với sức khỏe hoặc ảnh hưởng đến tính mạng của người sử dụng)
- Mức 2 là thuốc có bằng chứng không bảo đảm đầy đủ hiệu quả điều trị hoặc có nguy cơ không an toàn cho người sử dụng nhưng chưa đến mức gây tổn hại nghiêm trọng đối với sức khỏe hoặc chưa ảnh hưởng đến tính mạng của người sử dụng)
- Mức 3 là thuốc không thuộc trường hợp quy định tại Mục I, II mà do các nguyên nhân khác nhưng không ảnh hưởng đến hiệu quả điều trị và an toàn khi sử dụng.